Les océans absorbent une partie importante de nos émissions de gaz carbonique. Sur les 9 gigatonnes de carbone émises annuellement au cours de la dernière décennie, 2 gigatonnes environ sont captées par les océans. Le principal processus est la dissolution par l'océan du gaz carbonique atmosphérique jusqu'à ce que l'équilibre des pressions partielles dans ces deux milieux soit atteint. C'est la pompe physique de gaz carbonique. Mais une autre pompe est aussi à l’œuvre, due à la vie océanique, appelée la pompe biologique.
Le gaz carbonique est soluble dans l'eau de mer, tout comme l'azote et l'oxygène et la plupart des autres gaz. Il s'y trouve sous forme de gaz dissous, et aussi, en majeure partie, sous forme de carbonate CO--3 et de bicarbonate HCO-3, l'ensemble étant désigné par «carbone inorganique dissous», ou TCO2.
La distribution du carbone inorganique dissous présente dans tout l'océan des concentrations élevées en profondeur, de l'ordre de 2320 µmol/kg, et le plus souvent, des concentrations nettement plus faibles près de la surface, légèrement supérieures à 2000 µmol/kg (figure 1). Cette structure, très répandue dans les océans tropicaux, ne correspond pas à ce qu'on attendrait du brassage permanent effectué par les courants, dont l'action tendrait à établir partout une même concentration, constante, égale à la concentration moyenne de TCO2 dans tout l'océan. Un autre processus doit donc être à l’œuvre pour maintenir cette concentration plus faible près de la surface.
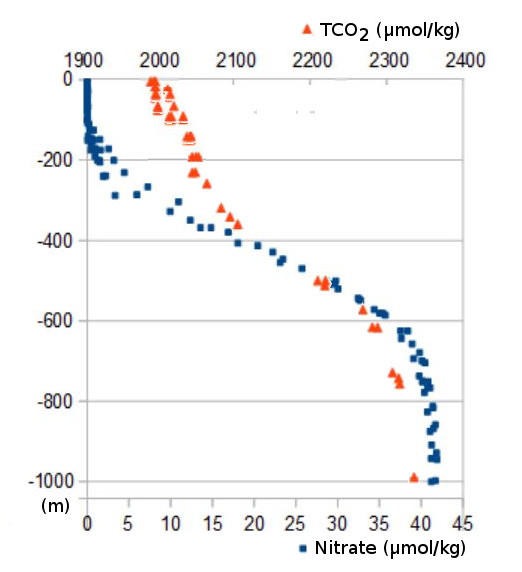
Figure 1 : profil vertical de la concentration en carbone inorganique dissous (triangles orange) et en nitrate (carrés bleus) au cours de l'été 2010 à 20°1' N, 166°11' W (station Aloha, Pacifique tropical).
Là en effet, la lumière pénètre, et la photosynthèse a lieu. Elle permet la croissance du phytoplancton, et, via les chaînes alimentaires, toute la vie marine : grâce à la photosynthèse, le phytoplancton fixe du gaz carbonique pour fabriquer ses tissus, selon la réaction :
6 CO2 + 6 H2O ==> C6H12O6 + 6 O2
Cette réaction retire du gaz carbonique dissous dans l'eau et le fixe dans la matière vivante, représentée dans l'équation ci-dessus par des hydrates de carbone. Après la mort des organismes vivants, la chute des débris vers la profondeur y entraîne le carbone ainsi fixé. Ceci abaisse la concentration en TCO2 dans la couche éclairée de surface, mais pourquoi n'atteint on pas des concentrations proches de zéro, au lieu des 2000 µmol/kg que montre la figure 1 ? En fait, la matière vivante n'est pas faite que d'eau et de gaz carbonique. Elle contient aussi de l'azote, du phosphore, et son élaboration met en jeu de nombreuses réactions chimiques où interviennent aussi l'oxygène, et des oligoéléments parmi lesquels le fer, qui, on le verra, pourrait jouer un rôle important.
La concentration en nitrate fixe la limite supérieure de la pompe biologique de carbone
L'absorption d'éléments chimiques dans la couche éclairée de l'océan par la vie marine s'effectue au départ par la photosynthèse selon les proportions de ces éléments au sein de la matière vivante. Certains éléments sont toujours en concentration suffisante dans l'eau de mer (c'est certainement le cas pour le chlore et le sodium!), mais d'autres peuvent venir à manquer. L'élément qui détermine le mieux le potentiel de production biologique de l'océan, et qui manque en premier au cours de la croissance du plancton, est l'azote. Il faut 1 atome d'azote pour 6,8 atomes de carbone (voir encart «les rapports de Redfield»).
Encart : les rapports de Redfield
Alfred Clarence Redfield est un physiologiste et océanographe américain qui a eu l'intuition que les éléments chimiques étaient absorbés par le plancton dans des proportions assez constantes, correspondant à la composition moyenne de la matière vivante marine, et que lors de la décomposition du plancton, ils étaient libérés dans l'eau de mer dans ces mêmes proportions. En se basant sur de très nombreuses mesures de ces éléments dans l'océan, à diverses profondeurs, il publia ses résultats en 1940, soit, pour un atome de phosphore, 16 atomes d'azote, et 106 atomes de carbone. D'un point de vue biogéochimique, il serait donc plus approprié d'écrire l'équation chimique de la photosynthèse sous la forme fictive :
H3PO4 + 16 HNO3 + 106 CO2 + 122 H2O ==> (CH2O)106(NH3)16H3PO4 + 138 O2
Des mesures beaucoup plus nombreuses ont été effectuées depuis, qui confirment la proportion de 16 atomes d'azote pour un de phosphore, mais indiquent un rapport entre le carbone et l'azote égal à 6,8, plutôt que la valeur 106/16 = 6,6 initialement trouvée. Ces rapports entre les quantités d’éléments chimiques mis en jeu par la vie marine sont à la base de la modélisation des flux biogéochimiques en mer.
Cette absorption s'arrête dès que les nitrates, qui sont la source initiale d'azote, sont épuisés dans la couche éclairée. Les disponibilités en nitrate, soit environ 42 µmol/kg (voir figure 1), limitent donc la fixation de carbone dans la matière vivante à 285 µmol/kg, ce qui correspond assez bien à l'écart entre la concentration de TCO2 en profondeur et celle en surface représentées sur la figure 1. Un constat identique pourrait s'appliquer au phosphore, dont les ressources disponibles en mer permettent la même croissance du phytoplancton que celles en nitrate (voir encart «Trichodesmium, un ascète qui se passe de nitrate»). Cette fixation de carbone dans la couche éclairée, puis la sédimentation des débris de la vie marine vers la profondeur, suivie de leur reminéralisation par les bactéries, constituent la «pompe biologique de carbone».
Le développement de la vie que permettent les nitrates disponibles réduit donc la concentration en TCO2 de la couche de surface de l'océan, qui est en équilibre avec l'atmosphère et sa concentration actuelle en gaz carbonique qui dépasse actuellement 400 ppm. S'il n'y avait pas de vie dans les océans, la concentration en TCO2 y serait uniforme, de l'ordre de 2320 µmol/kg. L'équilibre avec l'atmosphère s'y établirait alors avec beaucoup plus de gaz carbonique dans celle ci. Un calcul approximatif permet de donner un ordre de grandeur de ce que serait la teneur en gaz carbonique de l'atmosphère dans un océan sans vie : lorsque TCO2 varie de X %, la pression partielle océanique de CO2 varie de f . X %, où f est le facteur de Revelle (voir la Faq Comment le carbone agit sur le climat? ). f varie entre 9 et 13, avec les valeurs les plus élevées aux hautes latitudes. En adoptant une valeur égale à 10, qui correspond assez bien aux vastes océans tropicaux, et en y augmentant TCO2 en surface de 2000 à 2320 µmol/kg, soit 16 % d'augmentation, la pression partielle de CO2 y augmenterait de 160 %, poussant la concentration en CO2 atmosphérique de 400 à plus de 1000 ppm !
Toutefois, la situation représentée sur la figure 1 n'est pas la règle dans la totalité de l'océan, ni à toutes les saisons. En effet, aux hautes latitudes, le rayonnement solaire s'affaiblit en hiver et la photosynthèse ralentit fortement, de sorte que des nitrates subsistent en surface, accompagnée par des concentrations en TCO2 élevées. La zone équatoriale du Pacifique présente également des concentrations en surface de l'ordre de 5 µmol/kg (Figure 2). La persistance de nitrates non utilisés en surface suggère que la pompe biologique de gaz carbonique pourrait être plus efficace.
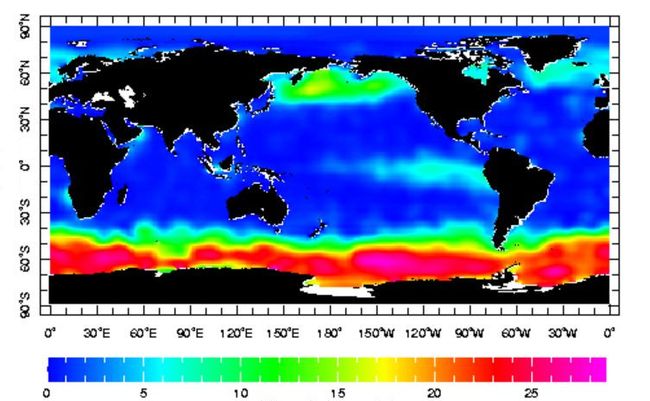 Figure 2 : concentration en nitrate à la surface de l'océan (µmol/kg)
Figure 2 : concentration en nitrate à la surface de l'océan (µmol/kg)
Quels éléments autres que le nitrate limitent la pompe biologique de gaz carbonique ?
La rémanence de nitrate en surface dans le Pacifique équatorial où l'éclairement permettrait une photosynthèse intense est surprenante. Le paradoxe «high nutrients – low chlorophyll» (HNLC) qui caractérise cette région a longtemps été attribué à la présence ininterrompue de conditions favorables à la vie, de telle sorte que le zooplancton s'y développe et broute le phytoplancton. Ce dernier ne peut donc pas avoir la croissance exponentielle qu'il atteint dans d'autres régions où les courants portent aussi des nitrates en surface. Mais on trouve aussi ce paradoxe dans l'océan Antarctique où, pourtant, après le retour d'une lumière généreuse au printemps, le phytoplancton se développe lentement. Le point commun entre ces deux régions est le très faible apport de poussières continentales par les vents dominants, dû à l'éloignement de toute source terrestre. Or, les sels de fer sont très peu solubles dans l'eau de mer, et ce sont les apports depuis les continents qui en constituent la principale ressource.
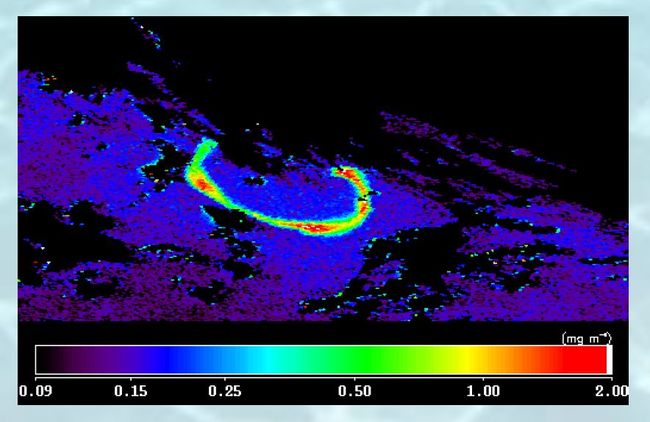
Figure 3 : développement d'une zone riche en chlorophylle vue par le satellite SeaWiFS après addition de fer dans l'océan (expérience SOIREE)
La limitation de la photosynthèse lorsque le fer manque a pu être démontrée, et l'idée a été émise par John Martin en 1988 que cette limitation pouvait expliquer le caractère HNLC du Pacifique équatorial, de l'Antarctique et d'autres régions recevant peu d'apports atmosphériques de poussières. John Martin a suggéré que répandre un tanker plein d'oxyde de fer dans l'Antarctique pourrait même déclencher une ère glaciaire. Des expériences d'enrichissement ont été menées dans l'Antarctique et dans le Pacifique équatorial. Elles n'ont eu qu'un résultat assez modeste, même si elles ont pu induire localement un verdissement de l'océan visible par satellite (figure 3). Enrichir artificiellement l'océan en fer afin de permettre à la pompe biologique de carbone d'exploiter en totalité le potentiel offert par les nitrates figure parmi les projets de géoingéniérie visant à lutter contre le réchauffement climatique.
La pompe biologique de carbone et le changement climatique
La quantité de nitrate dans l'océan varie peu, et très lentement. Il en va de même de l'éclairement solaire. Les conditions qui régissent la production de matière vivante dans les océans varient donc peu elles aussi. Cette production, et la pompe biologique de carbone qu'elle initie, pourrait toutefois varier si les apports de nitrate dans la couche éclairée par la circulation océanique venaient à être modifiés du fait du changement climatique. Une conséquence du réchauffement est un renforcement du contraste de température entre l'eau profonde et la couche de surface de l'océan, qui est aussi la couche éclairée où a lieu la photosynthèse. Ce renforcement du contraste de température implique aussi un renforcement du contraste de densité de l'eau; ceci réduirait les apports de nitrate par mélange turbulent, et devrait donc logiquement tendre à diminuer l'efficacité de la pompe biologique de carbone. Mais il peut aussi avoir un effet inverse : dans les régions tempérées ou froides, la faiblesse du contraste de densité fait que le brassage de l'eau s'exerce sur une grande profondeur, de telle sorte que le phytoplancton ne reçoit pas assez de lumière ; un renforcement de ce contraste contribue donc à maintenir le phytoplancton plus longtemps dans la couche éclairée, et ainsi à favoriser la pompe biologique de carbone. Il n'est pas clair actuellement de savoir lequel de ces deux processus, qui ont de toute façon peu changé l'un et l'autre, a dominé jusqu'à présent.
Une pompe biologique sans nitrate ?
«Azote» vient du grec «α» privatif et «zoien» vivre, et signifie donc «impropre à la vie». C'est bien ce qui caractérise l'azote de l'air, ou diazote, qu'on trouve aussi, dissous, dans l'eau de mer. C'est aussi le cas du protoxyde d'azote (N2O) ou du dioxyde d'azote (NO2). Le nitrate (NO-3) entre au contraire dans les réactions de la vie, de même que le nitrite (NO-2), l'ammoniaque (NH3) ou l'urée. En eau profonde, l'activité bactérienne reminéralise ces trois dernières formes en nitrate, et lorsque ces eaux profondes réapparaissent en surface, c'est le nitrate seul qui est au départ de la fabrication de matière vivante.
De même que sur les terres émergées certaines plantes sont capables de fixer l'azote atmosphérique, des cyanobactéries marines, principalement du genre Trichodesmium (voir encart «Trichodesmium, un ascète qui se passe de nitrate») sont capables de croître sans nitrate ou autre composé azoté réactif, en fixant le diazote dissous dans l'eau de mer (diazotrophie). Elles ont une croissance très lente car la diazotrophie demande de l'énergie (et aussi du fer), mais ce processus est intéressant car il représente un apport d'azote réactif dans le cycle océanique de l'azote. Cet apport est très difficile à quantifier, tout comme l'est la perte d'azote réactif par dénitrification, qui se produit en profondeur dans les régions de forte production biologique. Dans ces régions, les bactéries qui reminéralisent la matière organique abondamment produite près de la surface ont épuisé tout l'oxygène disponible et utilisent alors celui des ions nitrate, libérant ainsi des oxydes d'azote (NO2, N2O) qui sont émis dans l'atmosphère. Celui des deux phénomènes, diazotrophie ou reminéralisation, qui dominerait sur l'autre induirait une croissance ou une décroissance à très long terme (centaines de milliers d'années) du stock de nitrate océanique.
Encart : Trichodesmium, un ascète qui se passe de nitrate
Trichodesmium est une cyanobactérie qui comme d'autres très abondantes en mer, possède de la chlorophylle et croît par photosynthèse. Mais elle a en plus la particularité de pouvoir fixer l'azote atmosphérique, et ainsi de se passer de nitrate. Grâce à cela, elle pourrait donc proliférer partout dans les océans, et en particulier dans les régions tropicales, ou tempérées en été, où les nitrates de la couche de surface ont été entièrement consommés par le phytoplancton « classique ». Mais ce n'est pas vraiment le cas. D'abord, son métabolisme est gourmand en fer, et on ne le trouve donc que là où l'océan reçoit des apports de poussières atmosphériques abondants.

Trichodesmium forme des filaments de quelques centaines de cellules qui ont tendance à s'agglomérer en fagots
Ensuite, si Trichodesmium est capable de se passer de nitrate, il a tout de même besoin de phosphore, et les disponibilités et les besoins en phosphore de la vie marine sont tels que lorsque les nitrates sont épuisés, il ne reste que très peu de phosphore. C'est donc seulement ce phosphore résiduel qui va permettre la croissance des Trichodesmium. Les régions privilégiées sont celles où, du fait de l'absence de nitrate, la concurrence des autres espèces ne se fait pas sentir, et où les vents apportent des poussières depuis les continents. Ce sont donc les régions tropicales à proximité des continents.
Lorsque le phosphore résiduel est épuisé à son tour, les Trichodesmium cessent de croître et perdent certaines de leurs facultés d'adaptation. En particulier, ils ne parviennent plus à évacuer les gaz produits par leur métabolisme et se mettent donc à flotter à la surface des océans. Là, ils sont entraînés par les vents qui les concentrent dans les zones de convergence, où ils peuvent former des accumulations très denses et très visibles en surface, donnant l'impression que la mer est couverte de sciure de bois.

Trainées de Trichodesmium à la surface de la mer photographiées depuis la passerelle d'un navire.
Une pompe biologique sans «matière biologique»
Certains organismes marins fabriquent des pièces de calcaire, c'est à dire de carbonate de calcium. Ils prélèvent pour cela des ions carbonate et font diminuer TCO2. Mis à part les huîtres et autres coquillages côtiers, il s'agit de petits mollusques pélagiques (les ptéropodes), de protozoaires (les foraminifères) ou de phytoplancton (les coccolithophoridés). Ces pièces calcaires finissent par sédimenter vers la profondeur et opèrent donc un transfert de TCO2 de la surface vers la profondeur. Paradoxalement, ce transfert n'a pas pour effet de diminuer la pression partielle de gaz carbonique à la surface de l'océan (voir la FAQ : À propos d’Emiliana huxleyi, de son petit nom Ehux…). Il provoque au contraire son augmentation, car il diminue le pH de l'eau (i. e. augmente son acidité – chacun sait que verser de l'acide sur une roche calcaire provoque de l'effervescence par dégagement de gaz carbonique). Cette diminution du pH n'est compensée que par la lente restauration de l'alcalinité par l'érosion des silicates terrestres et leur apport par les fleuves.
