Résumé en langage courant
Le gaz carbonique, dont les rejets dans l’atmosphère entraînent un réchauffement du climat, se comporte de façon complexe : soluble dans l’eau comme les autres gaz, en quantité variable selon, principalement, la température, il s’y transforme en partie en acide carbonique, et modifie l’équilibre des ions carbonate et bicarbonate déjà présents dans l’eau. Cette interaction avec le système des carbonates augmente d’un ordre de grandeur la capacité des océans à absorber le gaz carbonique, par comparaison avec l’oxygène ou l’azote, ou la plupart des autres gaz, qui se dissolvent dans l’eau de mer seulement selon leurs propriétés physiques.
Toutefois, le gaz carbonique ne réagit pas instantanément avec la totalité des carbonates de l’océan : celui-ci est schématiquement partagé entre une couche de surface d’environ 100 m d’épaisseur, chauffée par le rayonnement solaire, et une couche d'eau profonde, froide et plus dense. La couche superficielle s’équilibre la première avec l’atmosphère, en un an environ. Ensuite, le nouvel équilibre des carbonates obtenu se propage lentement par mélange et sous l’action de la circulation générale océanique avec l’eau profonde. On considère que la durée de mise en équilibre de la totalité de l’océan après l’émission anthropique de gaz carbonique est supérieure à 1000 ans. À beaucoup plus long terme, l’érosion des terres émergées apporte aux océans des éléments qui, en augmentant l’alcalinité de l’eau et en diminuant son acidité, entretiennent de façon infinitésimale le puits océanique de carbone.
Les océans absorbent environ un quart de nos émissions de gaz carbonique, et contribuent ainsi à ralentir le réchauffement climatique en cours. La «pompe océanique de carbone», qui réalise cette absorption, est classiquement séparée :
- en pompe physique, basée sur des processus de diffusion, de solubilité, et de réactions chimiques,
- et en pompe biologique, due à la vie marine.
Cette dernière mobilise une partie du carbone des océans sous une forme organique, mais elle fonctionne à un rythme inchangé, et n’intervient pas dans les modifications climatiques en cours (1).
Nous ne nous intéresserons donc ici qu’à la pompe physique :
- le puits océanique de carbone qu’elle représente est-il voué à persister ?
- comment évoluera-t-il si nous arrêtons d’émettre ?
- quelles propriétés de l’océan peuvent être affectées ?
- un retour aux conditions préindustrielles est-il possible ?
Première étape : franchir l’interface océan-atmosphère
Le transfert du gaz carbonique (tout comme celui des autres gaz) de l’atmosphère vers l’océan dépend de la différence de la pression partielle de ce gaz de part et d’autre de l’interface, de sa solubilité, et de la vitesse de l’échange :
F = k s ΔPCO2
où F est le flux d’échange, s la solubilité du gaz considéré, ΔPCO2 sa différence de pression partielle (2) entre l’air et l’eau, et k est un coefficient de transfert qui définit la vitesse de l’échange, et croît avec la vitesse du vent. La solubilité décroît lorsque la température de l’eau augmente. Elle varie aussi selon la composition en carbonates de l’eau de mer.
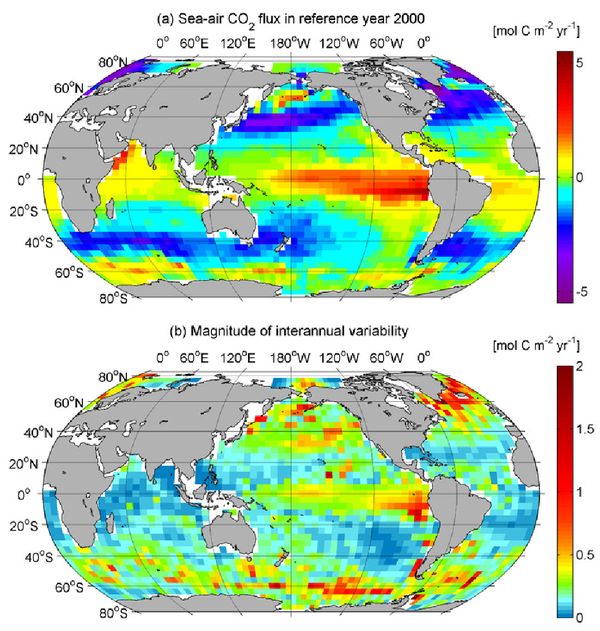
Figure 1 : a) flux annuel d’échange de gaz carbonique entre l’océan et l’atmosphère en 2000 : en jaune et rouge, le flux est dirigé vers l’atmosphère, en bleu et violet, vers l’océan. b) variabilité de ce flux (source : NOAA ).
Les flux d’échange de gaz carbonique à la surface de l’océan sont très variables d’une région à l’autre (figure 1). Cette variabilité résulte de la circulation océanique, et en particulier des remontées d’eau profonde, riches en carbonate, où elle est très élevée. Les variations de température (lorsque l’eau de mer se refroidit saisonnièrement de 1°C, la pression partielle de gaz carbonique y diminue de 2,3%), la photosynthèse par le phytoplancton qui consomme du gaz carbonique, et la force du vent, qui accélère les échanges jouent aussi un rôle.
Dans la majorité des régions tropicales, l’océan émet du gaz carbonique en direction de l’atmosphère. L’Océan Pacifique équatorial illustre bien les processus en jeu : des remontées d’eau froide par l’upwelling équatorial portent en surface des eaux très riches en carbonates, qui ont de ce fait une pression partielle en gaz carbonique élevée. Ces eaux dérivent ensuite lentement vers des latitudes plus élevées. Comme elles sont riches en sels nutritifs, elles sont le siège d’une photosynthèse active qui devrait y faire diminuer la pression partielle de gaz carbonique, mais sous l’action du soleil, elles se réchauffent, et ce réchauffement produit un effet inverse. Lorsqu’on s’éloigne de l’équateur, les sels nutritifs sont rapidement consommés et seul subsiste l’effet du réchauffement : les zones tropicales sont une source de gaz carbonique pour l’atmosphère. Ces eaux dérivent ensuite vers des latitudes plus élevées où le rayonnement solaire est moins intense et où elles tendent à se refroidir. Elles deviennent alors des puits pour le gaz carbonique de l’atmosphère.
À ce schéma général, s’ajoute une variabilité qui est principalement due à l’alternance des conditions saisonnières et à la réponse de la vie marine. Ainsi, aux latitudes élevées, le refroidissement hivernal favorise le mélange de l’eau de surface avec de l’eau profonde riche en carbonates et en sels nutritifs. Le faible éclairement en hiver ne permet pas à la photosynthèse de réduire la concentration en carbonates, et par conséquent, cette forte concentration s’accompagne d’une forte pression partielle de gaz carbonique, et le flux est vers l’atmosphère. Au printemps, l’éclairement solaire augmente, avec un triple résultat : le réchauffement de l’eau de surface favorise le maintien d’une couche d’eau chaude en surface, avec une pression partielle de gaz carbonique qui tend donc à augmenter, mais cela met fin au mélange avec l’eau profonde, et la photosynthèse devient rapidement très intense et réduit rapidement la pression partielle de gaz carbonique de la surface de l’océan. La région devient alors un puits de carbone. En été, les sels nutritifs ayant été épuisés par la photosynthèse, celle ci se réduit fortement, et c’est l’effet du réchauffement de l’eau qui domine : la région redevient une source. Enfin, en automne, sous l’influence du refroidissement saisonnier, elle redevient un puits.
Compte tenu de cette succession de phases puits et source intenses, le flux global net est difficile à estimer. La figure 2 extraite du cinquième rapport du GIEC indique ainsi que coexistent annuellement un flux de 80 gigatonnes de carbone (soit 290 GT de CO2) de l’atmosphère vers l’océan, et un flux de 78,4 gigatonnes en sens inverse, la différence égale à 1,6 gigatonnes représentant l’estimation du puits océanique de carbone en réponse à la perturbation anthropique.
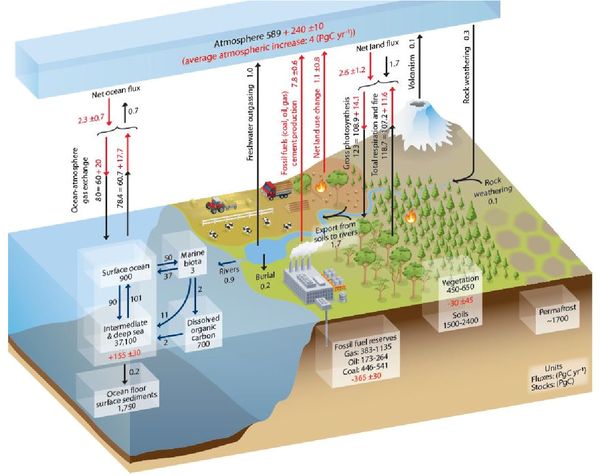
Figure 2 : flux et stock de carbone dans le système climatique, en noir pour les conditions préindustrielles, en rouge pour la perturbation anthropique. Unités : Petagrammes (un Petagramme = une Gigatonne). Source : 5ème rapport du GIEC.
Ce flux tend à équilibrer les pressions partielles de part et d’autre de l’interface océan-atmosphère et l’équilibre global est atteint en moyenne au bout d’une année. La pression partielle de gaz carbonique moyenne dans l’océan suit donc, avec un retard d’un an environ, celle dans l’atmosphère.
Deuxième étape : rejoindre le système des carbonates
Lorsque de l’oxygène, ou de l’azote, se dissout dans l’eau, il continue d’être de l’oxygène ou de l’azote. Il n’en va pas de même pour le gaz carbonique qui réagit avec l’eau pour donner de l’acide carbonique :
CO2 + H2O -------> H2CO3
L’acide carbonique se dissocie :
- en ions acides H+,
- en carbonates CO32- et en bicarbonates HCO3-.
La quantité
«HCO3- + CO3-- + CO2gaz»
est désignée ci-après par «carbone inorganique total», par opposition au «carbone organique» issu de la photosynthèse et qu’on trouve dans le plancton et ses débris.
Ces ions, ainsi que le gaz carbonique à l’état dissous, ne sont pas présents en quantités quelconques, mais sont en équilibre. L’alcalinité (concentration totale en ions négatifs), la température, la salinité interviennent dans cet équilibre, dont la forme suivante permet de comprendre les modifications :
2 HCO3- <---------> H2O + CO32- + CO2
La notion d’équilibre signifie que si l’on ajoute une quantité d’un des éléments qui figurent dans cette relation, la réaction s’active de façon à compenser cet apport. Ainsi, si on ajoute des ions bicarbonate HCO3-, on crée un excédent à gauche de la relation d’équilibre, et cette relation va s’activer vers la droite, et transformer une partie des ions ajoutés en carbonates CO32- et en gaz carbonique : la concentration de ce dernier, et donc sa pression partielle, vont augmenter. Lorsque, au contraire, du gaz carbonique atmosphérique pénètre dans l’océan, il s’ajoute à la partie droite de la relation d’équilibre, qui va donc s’activer vers la gauche, et réduire ainsi l’apport de gaz carbonique : une partie du gaz carbonique qui pénètre dans l’océan y est absorbée par le système des carbonates. Pour atteindre l’équilibre des pressions partielles, il faut donc en ajouter encore, et encore ! Cette implication avec le système des carbonates est la cause de l’efficacité du puits océanique de carbone. Roger Revelle, le premier à s’être intéressé à la pénétration du gaz carbonique anthropique dans l’océan, a formulé les variations relatives de la pression partielle de gaz carbonique et de la quantité de carbone inorganique dissous total :
TCO2 = HCO3- + CO3-- + CO2gaz
sous la forme :
f = (ΔPCO2 / PCO2) / (ΔTCO2 / TCO2)
où f est le facteur de Revelle, et ΔPCO2 et ΔTCO2 sont les variations de ces deux quantités. La valeur de f varie entre 8 et 14 (figure 3). Ainsi, pour une valeur égale à 10, si la concentration en carbone inorganique total dans l’eau de mer augmente (ou diminue) de 1%, la pression partielle de gaz carbonique à la surface de l’océan amplifie cette variation en augmentant (ou en diminuant) de 10%.
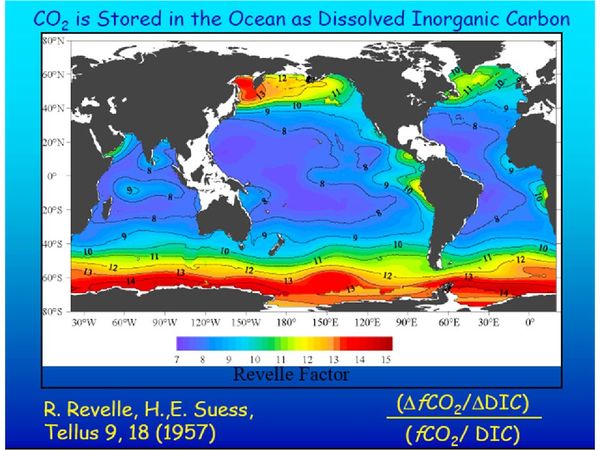
Figure 3 : distribution des valeurs du facteur de Revelle dans les océans. Les valeurs les plus grandes se situent dans les régions froides où le mélange avec l’eau profonde amène en surface des eaux à faible pH et à forte concentration en carbonates).
Le facteur de Revelle est donc un indicateur de l’efficacité avec laquelle l’océan s’équilibre en gaz carbonique avec l’atmosphère. Pour un même écart de pression partielle, la quantité de gaz carbonique que l’océan absorbe pour atteindre l’équilibre est d’autant plus petite que le facteur de Revelle est élevé. Ainsi, pour que l’océan s’ajuste à une hausse de la concentration en gaz carbonique dans l’atmosphère de une partie par million, il doit augmenter sa concentration en carbone inorganique total de 0,75 µmole/kg si le facteur de Revelle est égal à 9, mais de seulement 0,5 µmole/kg si sa valeur est 12. Or, à cause de l’augmentation de la concentration en carbone inorganique total dans l’océan, du fait des rejets anthropiques, ce facteur augmente, tandis que le pH de l’eau de mer diminue, signe de son acidification (figure 4). Le puits de carbone océanique devient donc de moins en moins efficace à mesure que nous émettons du gaz carbonique, puisque, pour une hausse identique du contenu en CO2 de l'atmosphère, il absorbe de moins en moins de CO2.
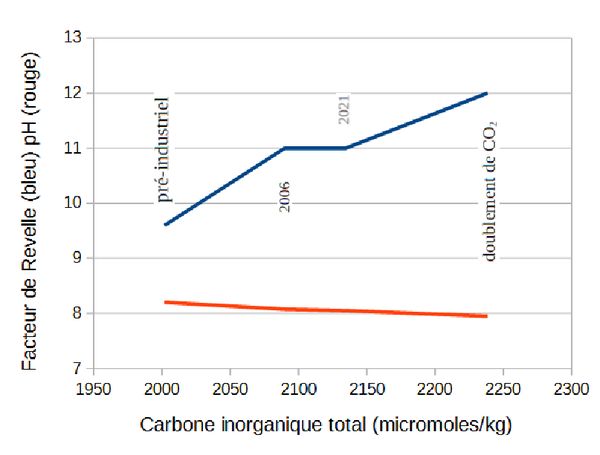
Figure 4 : variation du facteur de Revelle et du pH de l’eau de mer en fonction de l’augmentation de la concentration en carbone inorganique total due à la pénétration du gaz carbonique d’origine anthropique dans l’océan (calculs réalisés selon Tans et al., 1998 ; l’évolution des carbonates après 2006 est estimée d’après Kapsenberg et al., 2017).
Troisième étape : se propager dans l’océan profond
On peut représenter très simplement l’océan comme la superposition de deux couches : une, profonde et froide, et l’autre, en surface, d’une centaine de mètres environ, chauffée par le rayonnement solaire, et de ce fait, moins dense que l’eau profonde. Si seule la couche supérieure recevait le gaz carbonique anthropogénique, sa mise en équilibre avec l’atmosphère nécessitant moins d’un an, un arrêt de nos émissions signifierait un arrêt rapide du puits océanique. Ce n’est heureusement pas le cas. Les deux couches se mélangent, grâce en particulier à des zones où la circulation océanique crée des remontées d’eau profonde jusqu’en surface (cas des upwellings tropicaux) ou d’autres au contraire, aux latitudes élevées, où l’eau de surface se refroidit et, ainsi devenue plus dense, rejoint l’eau profonde. Enfin, partout dans l’océan, la séparation entre les deux couches n’est pas totale et la turbulence favorise des mélanges. De surcroît, la vie marine génère dans la couche superficielle des débris organiques qui, en sédimentant vers la profondeur, y transfèrent du carbone.
Les mélanges, ou les remontées d’eau profonde, portent donc au contact de l’atmosphère des eaux qui ont été en contact avec l’atmosphère à une période où celle ci avait une concentration en gaz carbonique inférieure à ce qu’elle est aujourd’hui, voire celle qui régnait avant l’ère industrielle (280 ppm). Leur système des carbonates correspond à une atmosphère moins concentrée en gaz carbonique, et leur mise en équilibre avec l’atmosphère actuelle implique donc qu’elles absorbent du gaz carbonique. Ainsi, le puits océanique de carbone se poursuivra même si nos émissions s’arrêtent totalement. Ainsi, après que le brassage de l’océan tout entier a été réalisé, soit au bout de 1000 ou 2000 ans environ, 60% du gaz carbonique émis par les activités humaines aurait été retiré de l’atmosphère (figure 5).
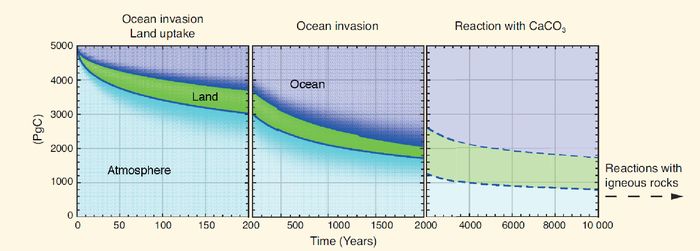
Figure 5 : décroissance d’une émission de 5000 Pg de carbone anthropique dans l’atmosphère et sa redistribution dans l’océan (bleu) et la végétation des terres émergées (vert). Au cours des 200 premières années après l’émission, l’océan en absorbe environ 25 %, puis 60 % après que l’océan s’est totalement mélangé, en 2000 ans environ. Par la suite, la dissolution des carbonates des sédiments, et l’apport de carbonates via l’érosion des roches basiques sur les continents prolongent très lentement cette décroissance. (5ième rapport du GIEC, FAQ 6.2, fig.2).
Quatrième étape : réagir avec les roches
Une éventuelle poursuite de la pénétration du gaz carbonique dans l’océan est beaucoup plus incertaine. Elle repose sur une augmentation du pH de l’eau (c’est à dire une diminution de son acidité) grâce à laquelle le gaz carbonique y deviendrait plus soluble. C’est l’apport très lent d’ions carbonate dû, d’une part, à la dissolution des sédiments marins par l’eau de mer rendue plus acide à cause de la perturbation anthropique, et d’autre part à l’érosion des roches des continents et à l’apport d’éléments basiques. L’effet de ces apports sera d’augmenter le pH et l’alcalinité de l’eau de mer, ce qui aura pour effet d’y augmenter la solubilité du gaz carbonique. Mais ceci prendrait des centaines de milliers d’années (3).
Notes :
(1) La pompe biologique océanique de carbone est un élément important du système climatique. Elle résulte de la photosynthèse du plancton, qui, en présence de lumière, fixe du gaz carbonique sous forme de matière organique, dont les débris en s’enfonçant retirent du carbone de la couche éclairée de surface. Le carbone ainsi exporté vers la profondeur est associé à de l’azote dans la proportion de 6,8 atomes de carbone pour un atome d’azote. C’est la quantité d’azote disponible dans l’océan, qui ne varie pas de façon significative, même aux très longues échelles de temps qui caractérisent le système climatique actuel, qui fixe les limites de cette pompe biologique océanique de carbone. Sans ce processus, on aurait en surface des carbonates avec la même concentration qu’en profondeur, et la pression partielle de gaz carbonique serait beaucoup plus élevée : la concentration moyenne en carbone inorganique dissous dans l’océan à l’époque préindustrielle était de 2260 µmol/kg, et avec une telle valeur en surface, l’équilibre avec l’atmosphère se serait établi à plus de quatre fois les 280 ppm de gaz carbonique de cette période. Le climat de l’holocène dans ces conditions aurait très différent, et les épisodes glaciaires de l’ère quaternaire n’auraient sans doute pas existé. La vie marine a donc beaucoup contribué à définir le climat que nous connaissons, mais elle ne paraît pas susceptible de le changer. Il faudrait pour cela une évolution des flux mis en jeu par cette pompe biologique en réponse au changement climatique ; une telle évolution est scrutée par les spécialistes, mais ne semble pas encore pouvoir être détectée (Gregg et Rousseaux, 2014).
Retour texte.
(2) La pression partielle du gaz carbonique dans l’atmosphère est égale au produit de la pression atmosphérique par la proportion de ce gaz dans l’atmosphère. Ainsi, dans de l’air sec et à la pression atmosphérique normale, le gaz carbonique dont la concentration est en 2021 égale à 417 parties par million aurait une pression partielle de 417 micro-atmosphères. Dans les conditions réelles, étant donné que la pression atmosphérique varie relativement peu, et que le contenu en vapeur d’eau de l’atmosphère est faible, la pression partielle de gaz carbonique s’écarte peu de cette valeur, et lorsqu’on ne recherche pas la précision, le chiffre de la concentration de l’atmosphère en gaz carbonique est souvent utilisé pour estimer sa pression partielle en micro-atmosphères.
Retour texte.
(3) Augmenter l’alcalinité des océans en y déversant des roches basiques finement broyées fait partie des solutions proposées par la géo-ingénierie pour stimuler le puits océanique de carbone. L’une de ces roches, l’olivine, très abondante, est la plus souvent proposée pour cela. Il reste à démontrer que son broyage ne générera pas davantage d’émissions de carbone qu’il permettra d’en absorber !
Retour texte.
Références :
Climate change 2013 : the physical science basis. 5ième rapport du GIEC, 2013.
Gregg, W. W., and Rousseaux, C. S. (2014). Decadal trends in global pelagic ocean chlorophyll: a new assessment integrating multiple satellites, in situ data, and models. J. Geophys. Res. Oceans 119, 5921–5933.
Kapsenberg, L., Alliouane, S., Gazeau, F., Mousseau, L., and Gattuso, J.-P.: Coastal ocean acidification and increasing total alkalinity in the northwestern Mediterranean Sea, Ocean Sci., 13, 411–426, https://doi.org/10.5194/os-13-411-2017, 2017.
P. Tans, “Why Carbon Dioxide from Fossil Fuel Burning Won't Go Away” In: MacAladay, J. (ed), “Environmental Chemistry,” Oxford University Press, 1998. pp. 271-291.
Quelques définitions
Facteur de Revelle : rapport entre l'augmentation relative de la pression partielle de gaz carbonique dans l'eau de mer et l'augmentation relative de la concentration en carbone inorganique total (voir glossaire : système des carbonates). Ce rapport augmente à mesure que l'océan absorbe les émissions de gaz carbonique anthropiques et devient plus acide, et par conséquent, pour un même écart de pression partielle entre l'océan et l'atmosphère, l'océan a besoin d'absorber de moins en moins de gaz carbonique pour rétablir l'équilibre avec l'atmosphère.
Puits océanique de carbone : ensemble des processus par lesquels l'océan absorbe une partie des émissions anthropiques de gaz carbonique. On distingue la pompe physique, par laquelle le gaz carbonique pénètre dans l'eau de mer en fonction de sa solubilité, jusqu'à équilibre des pressions partielles entre les deux milieux, et la pompe biologique, qui résulte de la transformation du gaz carbonique en matière vivante par la photosynthèse, puis à sa soustraction de la couche superficielle de l'océan lorsque les débris issus de la matière vivante sédimentent vers la profondeur.
Système des carbonates : concentration en gaz carbonique, carbonates (CO32-) et bicarbonates ‘HCO3-) et état d’équilibre entre ces formes dans l’océan. La somme de ces trois formes est désignée par "carbone inorganique total", en anglais DIC (pour "dissolved inorganic carbon").
En voir plus dans le Glossaire.
FAQ
Comment les nitrates contrôlent-ils la pompe biologique de carbone dans l'océan?
